发布时间:2024-04-12 16:33:36 来源:网络
随着医疗器械产业快速崛起,"服务"与"再制造"之别已成为公众关注焦点。2021年6月24日,美国食品药品监督管理局(FDA)颁布了《医疗器械再制造指南草案》,以明晰"再制造"概念,并提供标签信息建议,保障设备在整个使用寿命中的质量、安全及效能。本文将深入剖析该指南草案的核心要义。
FDA相关背景介绍
美国食品药品监督管理局(FDA)一直重视区分"服务"和"再制造"的行为标准。近期,该机构对设备重用及修理可能引发的问题展开了深度研究。新公布的指引草案旨在明确原设备制造商以及第三方在相关设备中的操作规范,是否属于再制造范畴,借此避免重大政策改革。这份文件主要致力于厘清FDA现行的适用定义,并进一步明确再制造商需遵循的法规要求。值得注意的是,该指南适用于所有符合《食品、药品和化妆品法》定义的设备,不论其分类为何,如I类、II类或III类,但不包含经过再加工的一次性设备。
服务与再制造区别
本篇文章详细阐述了服务与再制造业这两个概念的本质区别。服务主要涵盖产品销售后的维护保养或定期检查活动,以确保零部件的性能和安全要求能达到制造商设定并始终符合原始设计宗旨。这种维护过程不会对产品安全性或性能产生显著影响,也未改变原始设计理念。再制造业则是通过深度改造、精处理、翻新和重新包装等方式,提升产品性能或安全规格,甚至可能改变其原有用途。同时,文章还深入解析了修理、修复、翻新、重建等相关术语的含义。
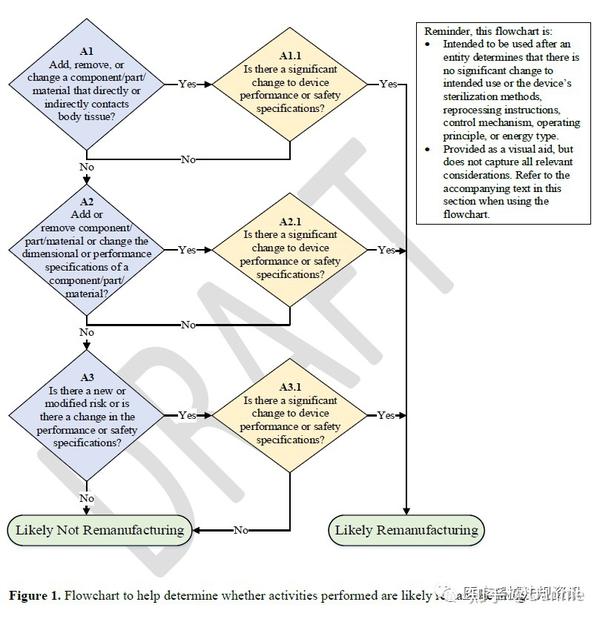
判断活动是否为再制造
本文将详细解析如何准确判定活动是否属于再制造领域。评估标准包含功能性转换、产品安全及性能参数的显著改变和新上市申请的提交等多方面。美国食品药品监管局(FDA)提倡设立专门流程来明确活动归属,同时列举出可被纳入再制造范围的各种实例。
软件变更活动
除了特定软件变更活动以外,其余软件调整极有可能被认定为整修行为。对于此类情况,我们需审慎评估其对设备性能及安全风险有无重大影响,并确保所有相关信息得以妥当保存。实际上,美国食品药品监督管理局(FDA)亦已举例说明如何将软件变更活动划分为整修范围。
评估示例与文档
本文深入解析如何精准认定特定活动是否属于再制造范畴及其评估资料示例。透过实例剖析与流程图解,协助读者更深度地掌握及运用指南所提供的准则进行再制造判别。











